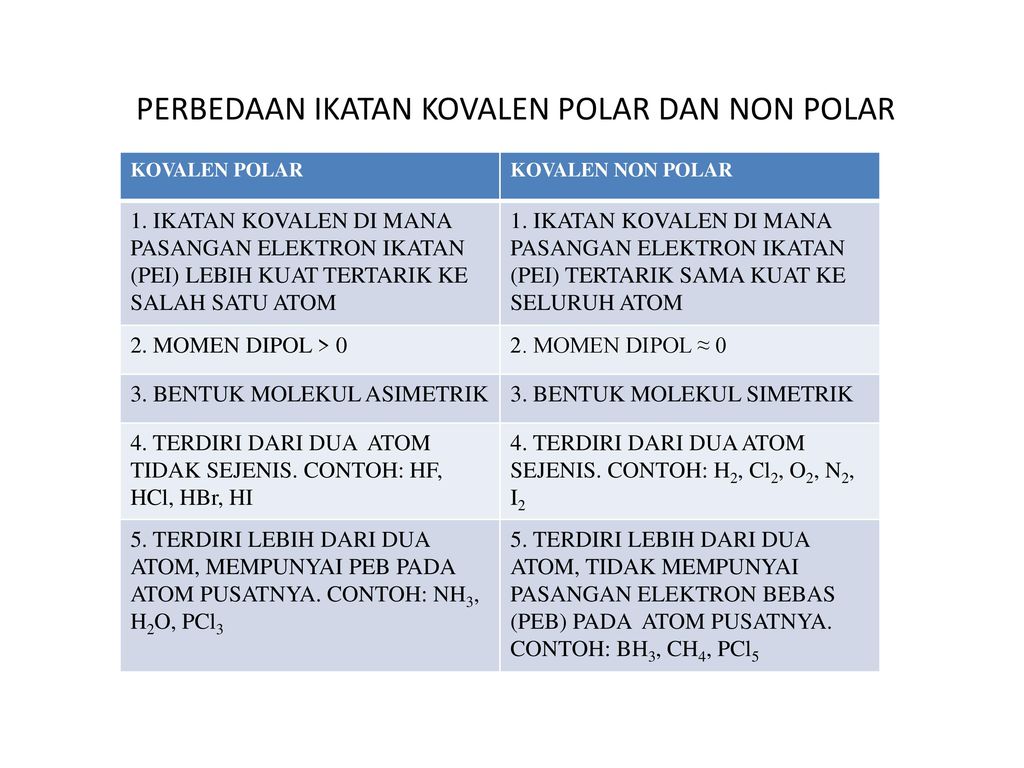
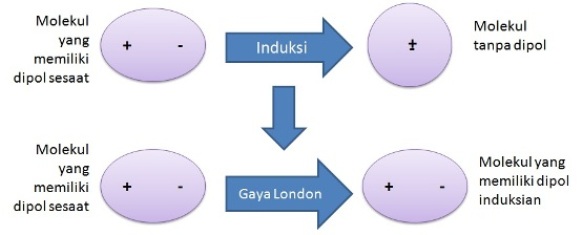
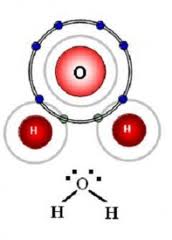
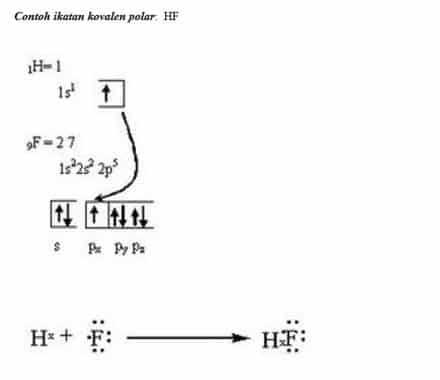
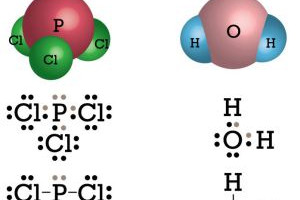
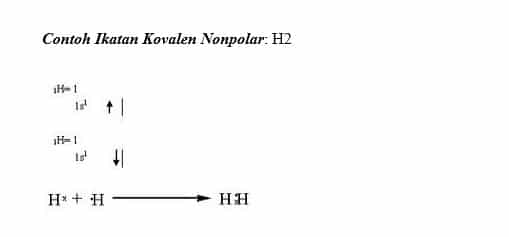
Sususnan elektronnya asimetris 4. Ok mari kita kerjakan.
Kelas 10 007 Ikatan Kimia
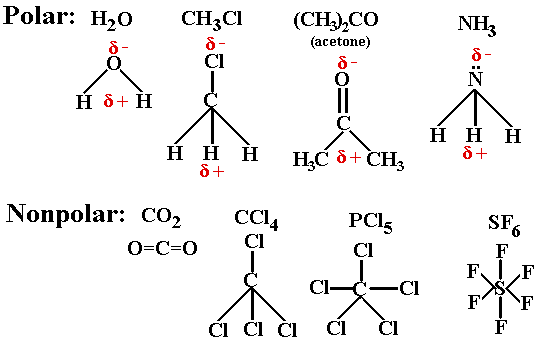
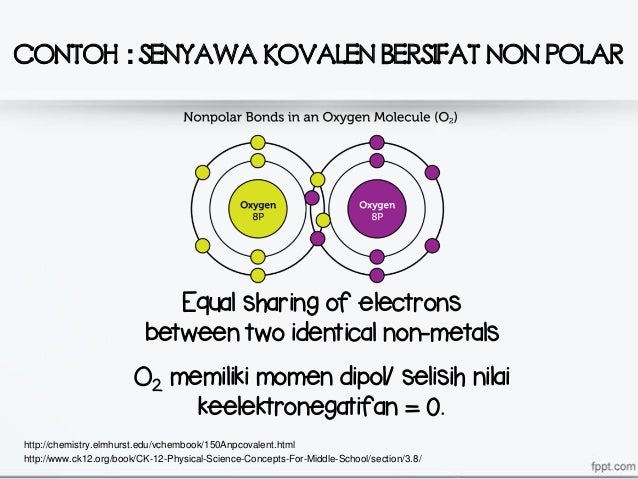
Contoh senyawa non polar. Senyawa polar dan non polar pengertian ciri kovalen perbedaan sifat titik didih contoh. Ikatan antara 8 o dengan 8 o. Susunan elekronnya simetris 3. Contoh pelarut non polar yaitu. Perhatikan struktur salah satu ikatan kovalen non polar dari ch 4 berikut. Contoh molekul polar meliputi.
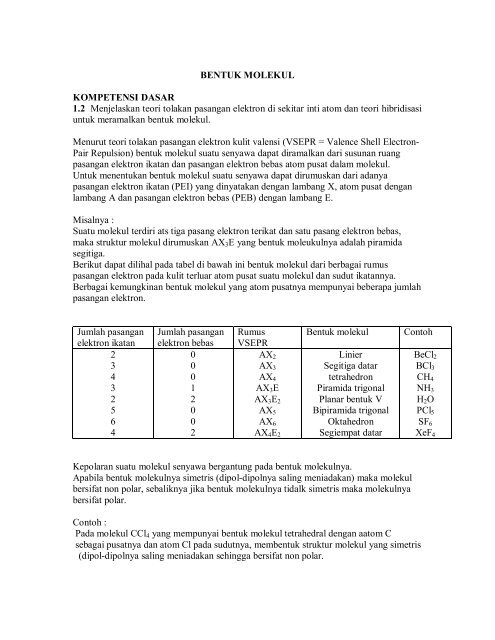
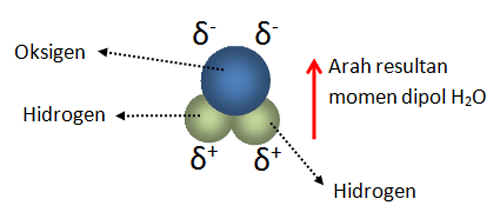
Air h2o amonia nh3 belerang dioksida so2 hidrogen sulfida h2s etanol c2h6o. Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa distribusi elektronnya dan ukuran kuantitatif titik didih. Untuk dapat menentukan senyawa tersebut termasuk senyawa polar atau nonpolar kita harus mengetahui struktur lewis nya terlebih dahulu. Mempunyai atom yang elektronegatif tinggi seperti golongan 567 3. Ini terdiri dari molekul non polar dan dapat melarutkan senyawa atau zat terlarut non polar. Pelarut non polar mengandung ikatan dengan atom elektronegatif yang sama seperti c dan h.
Cl2 pcl5 h2 n2. Ciri ciri senyawa polar dan non polar adalah. Jika perbedaan elektronegativitas antara atom lebih besar dari 20 ikatannya bersifat ionik. Tidak ada peb diatom pusat 2. Perhatikan senyawa ionik seperti natrium klorida nacl bersifat polar. Lihat juga materi kimia lainnya.
Mempunyai unsur yang berkutub dan berkutub kalau non polar. Mempunyai peb diatom pusat 2. Contoh senyawa lain yang memiliki bentuk molekul simetris dan bersifat nonpolar adalah ch 4 bh 3 bcl 3 pcl 5 dan co 2. Senyawa ionik adalah molekul yang sangat polar. Atomnya harus berbeda 5.