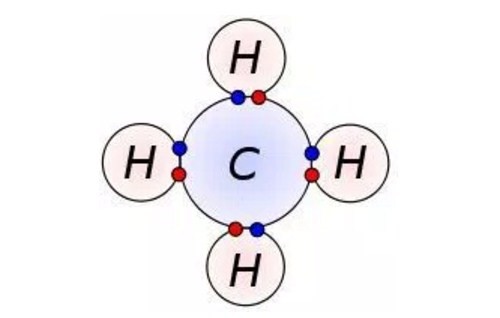
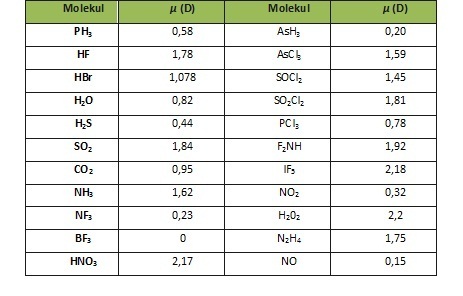
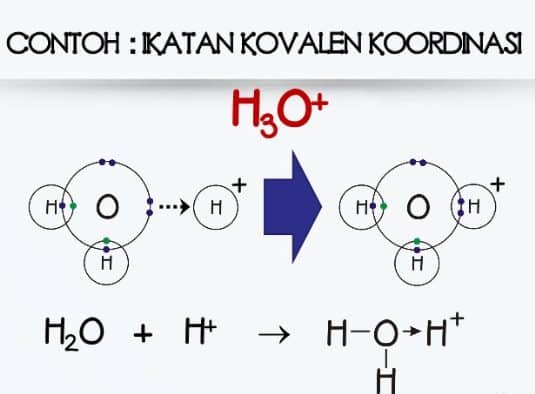
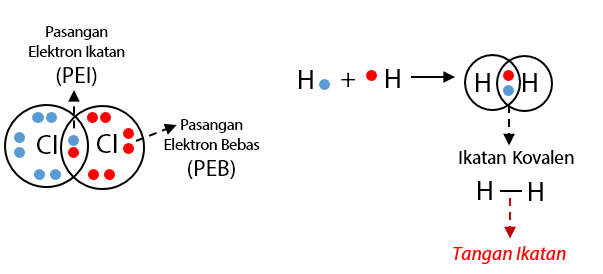
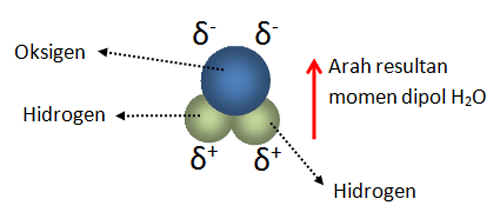
Dengan demikian pada senyawa yang berikatan kovalen tidak terjadi pengutuban muatan. 8 o 2 6.

Ikatan Kovalen Polar Your Chemistry A
Contoh senyawa kovalen polar. Ikatan kovalen non polar. Contoh senyawa kovalen non polar h2 n2 cl2 br2 i2 ch4 ccl4 bcl3 no2 sf6 bf3 co2 dll ok beitulah penjelasan mas dennis mengenai pengertiansifat dan contoh dari senyawa kovalen. Contoh ikatan kovalen polar dan non polar proses pembentukan pengertian soal kunci jawaban kepolaran senyawa unsur kimia pernahkah anda melihat air dengan minyak tidak bercampur satu sama lain. Senyawa kovalen dikatakan non polar jika senyawa tersebut tidak memiliki perbedaan keelektronegatifan. Contoh ikatan kovalen polar. Ikatan antara 1 h dengan 53 i.
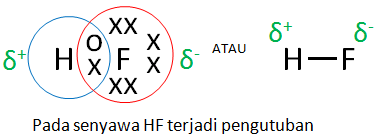
Contoh ikatan kovalen polar hf. Ikatan kovalen nonpolar adalah ikatan kovalen yang pasangan elektron ikatannya pei tertarik sama kuat ke arah atom atom yang berikatansenyawa kovalen nonpolar terbentuk antara atom atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol 0 nol atau mempunyai. Dlm senyawa hf ini f mempunyai keelektronegatifan yang tinggi jika dibandingkan h. Ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara sama. Ikatan kovalen nonpolar adalah ikatan kovalen yang pasangan elektron ikatannya pei tertarik sama kuat ke arah atom atom yang berikatan. Sehingga pasangan elektron lebih tertarik kearah f akibatnya akan terbentuk dipol dipol atau terjadi pengkutuban terbentuknya kutub antara h dan f.
Perhatikan struktur lewis untuk senyawa pcl 3 dan h 2 o berikut. Dan salam chemistry. Bagaimana suatu ikatan kovalen suatu senyawa dapat mempengaruhi kepolaran. Contoh senyawa kovalen polar yaitu hcl hbr hi hf h 2 o dan nh 3contoh senyawa kovalen nonpolar yaitu h 2 o 2 n 2 cl 2 ch 4 c 6 h 6 dan bf 3. Semoga artikel ini dapat membantu dan menambah wawasan sobat semuanya. Metana adalah contoh dari senyawa kovalen.
Air dan minyak merupakan suatu senyawa kovalen yang memiliki kepolaran berbeda. 53 i 2 8 18 18 7. Karena tidak terdapat perbedaan keelektronegatifan maka senyawa o 2 termasuk senyawa nonpolar. Senyawa yang terbentuk dari dua atau lebih unsur non logam seperti karbon dan hidrogen yang disebut senyawa kovalen. Senyawa kovalen dikatakan non polar jika senyawa tersebut tidak memiliki perbedaan keelektronegatifan. Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa distribusi elektronnya dan ukuran kuantitatif titik didih.
Karena terdapat perbedaan keelektronegatifan maka senyawa hi termasuk senyawa polar. Dalam senyawa kovalen atom dari unsur unsur yang berbeda ada di dalam molekul oleh ikatan kovalen. 1 h 1. Senyawa polar dan non polar pengertian ciri kovalen perbedaan sifat titik didih contoh. Ini adalah ikatan kimia dengan atom berbagi elektron valensi. Contoh senyawa kovalen polar adalah nh 3pcl 3 h 2 o dan cl 2 o.