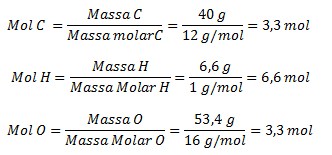Suatu senyawa organik tersusun dari 40 persen karbon 66 persen hidrogen dan sisanya oksigen ar c12 h1 o16. Rumus kimia atau umum disebut juga rumus molekul adalah cara ringkas memberikan sebuah informasi mengenai perbandingan atom atom yang menyusun pada suatu senyawa kimia tertentu.
Cara Menentukan Rumus Molekul Senyawa Idschool
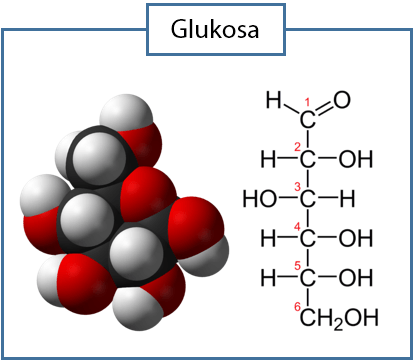
Contoh rumus molekul senyawa. Terdapat suatu senyawa organik yang tersusun dari 40 persen karbon 66 persen hidrogen dan sisanya oksigen. Rumus empiris dari suatu senyawa menunjukkan jumlah atom relatif dari masing masing unsur dalam molekul senyawa tersebut dengan rasio perbandingan bilangan bulat paling sederhana. Untuk semakin menambah pemahaman anda mengenai rumus molekul berikut kami bagikan contoh soal lengkap dengan pembahasannya selengkapnya. Suatu senyawa hidrokarbon mengandung 48 gram c serta 8 gram h ar c 12 ar h 1. Sebagai contoh rumus empiris dari asam askorbat adalah c 3 h 4 o 3 di mana perbandingan jumlah atom karbon hidrogen dan oksigen adalah 3. Glukosa memiliki rumus molekul c 6 h 12 o 6 sumber.
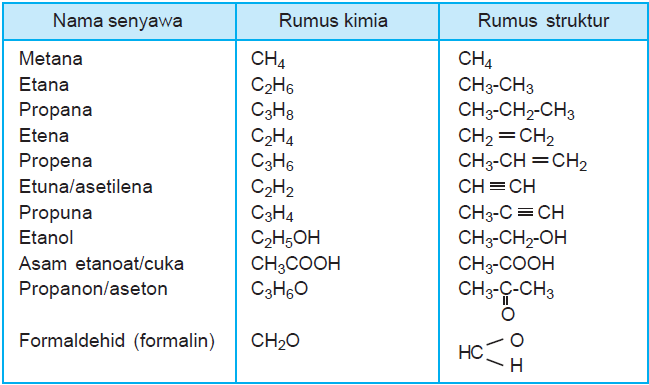
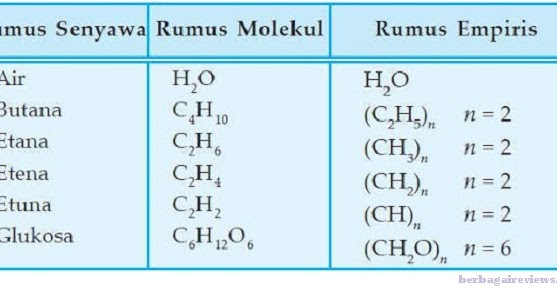
Rumus molekul dan rumus empiris senyawa hanya terjadi perbedaan jumlah atom sedangkan atom unsur penyusun senyawa tetap. Co2 karbon dioksida co2 ini adalah salah satu hasil dari penggambungan antara satu atom karbon serta dua atom oksigen. Senyawa anorganik adalah senyawa senyawa yang tidak disusun dari atom karbon umumnya senyawa ini ditemukan di alam beberapa contoh senyawa ini seperti garam dapur natrium klorida dengan lambang nacl alumunium hidroksida yang dijumpai pada obat maag memiliki lambang aloh 3demikian juga dengan gas yang terlibat dalam proses respirasi yaitu gas oksigen dengan lambang o. Gas alam dan bahan bakar. Contoh soal rumus empiris dan rumus molekul senyawa. Secara umum rumus molekul senyawa dapat ditulis sebagai berikut ini.
Rumus air contoh senyawa hidrokarbon 1. Pada rumus kimianya terdiri dengan karbon dan hidrogen atom pada beberapa rasio dan konfigurasi kimia. Karena molekul air tersusun atas atom atom unsur yang berbeda maka molekul air termasuk dalam molekul senyawa. Contohnya seperti metana butana propana dan heksana dengan memiliki hidrokarbon. Di sini anda juga dapat lihat jika atom h mempunyai perbedaan dengan atom jenis o. Memakai sebaris simbol zat kimia nomor dan kadang kadang simbol yang lain juga seperti misalnya tanda kurung kurung siku dan tanda plus dan minus.
Banyak sumber bahan bakar yang telah digunakan yaitu hidrokarbon. Beberapa contoh molekul senyawa lainnya adalah gas karbon monoksida co gas karbon dioksida co 2 garam dapur nacl dan kalium hidroksida kloh 2. Carilah rumus molekul senyawa itu apabila diketahui massa molekul relatifnya ialah 28. Dibawah ini penulis telah memberikan beberapa contoh soal rumus molekul senyawa dan rumus empiris tujuannya agar memudahkan bagi kalian para pembaca dalam memahami materi kimia empiris dan molekul senyawa ini. Berikut beberapa contoh soal rumus empiris dan rumus molekul suatu senyawa. Prinsip tersebut digunakan sebagai dasar dalam mencari rumus molekul senyawa.